检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
单胺类化合物,如多巴胺、5-羟色胺、去甲肾上腺素、肾上腺素和组胺,是神经系统中重要的神经递质,负责调控多种生理和认知功能,如运动、睡眠、奖赏和情绪等。单胺环路功能异常会引起抑郁症、帕金森氏症和舞蹈症等精神类或神经退行性疾病。囊泡单胺转运蛋白(vesicular monoamine transporters, VMATs)将突触前神经元合成的单胺类化合物转运进分泌囊泡,这是单胺类神经递质向突触间隙有效释放的前提。临床上,VMATs已经被作为高血压、亨廷顿氏舞蹈症等运动障碍、精神性焦虑以及精神性兴奋剂滥用的潜在治疗靶点。
哺乳动物中存在两个VMAT家族成员,VMAT1(SLC18A1)和VMAT2(SLC18A2)。VMAT1蛋白仅在外周神经分泌细胞中表达,而VMAT2蛋白则在中枢和外周神经系统中广泛表达并承担主要的囊泡单胺转运功能。因此,VMAT2是目前多种单胺异常相关疾病治疗药物的主要靶点。VMAT2的抑制剂丁苯那嗪(tetrabenazine, TBZ)及其衍生物氘代丁苯那嗪(deutetrabenazine)和缬苯那嗪(valbenazine)已经被FDA批准用于治疗亨廷顿氏舞蹈症或迟发性运动障碍(tardive dyskinesia);另一个VMAT2的抑制剂利血平(reserpine, RSP)则是最早的交感神经抑制类降压药。此前的研究显示,TBZ及其衍生物和RSP对VMAT2的抑制机制不同:TBZ是非竞争性抑制剂,而RSP是竞争性抑制剂;而且,TBZ特异性抑制VMAT2,而RSP是VMAT1和VMAT2共同的抑制剂。然而,目前VMAT蛋白底物转运和药物作用的分子机制均不明确。
2023年11月1日, 北京大学生命科学学院张哲课题组和美国圣裘德儿童研究医院李佳学课题组合作在Nature杂志发布了题为“Mechanisms of neurotransmitter transport and drug inhibition in human VMAT2”的研究论文。该工作首次报道了人源VMAT2蛋白结合抑制剂TBZ、RSP及其底物5-羟色胺(5-HT)的冷冻电镜结构,揭示了两种抑制剂发挥功能以及VMAT2转运底物的分子机制(图1)。
VMAT2蛋白的分子量仅约56 kDa且缺乏可溶结构域,这对使用冷冻电镜技术进行结构解析提出了巨大的挑战。作者采取融合蛋白的策略,将MBP蛋白刚性融合在VMAT2的N端,同时将与MBP特异性结合的DARPin蛋白融合在VMAT2的C端,从而增大了VMAT2的分子量并提高了蛋白的稳定性,借此获得了VMAT2与几种小分子复合物的高分辨率结构(2.9-3.7 Å)(图1A)。作者首先解析了VMAT2结合TBZ的结构。在该结构中,VMAT2蛋白呈现lumen-facing构象,TBZ的结合将VMAT2进一步锁定在occluded状态,此时VMAT2对膜两侧均不开放,由此阻碍了底物的结合和转运(图1A)。此前的研究表明,VMAT2在cytoplasm-facing构象时与RSP的亲和力较强,为了获得与RSP的复合物结构,作者对VMAT2胞质侧门控处关键氨基酸残基进行了突变,最终解析了VMAT2突变体Y418S在cytoplasm-facing构象下与RSP以及底物5-HT的复合物结构。这两个结构显示,5-HT与RSP结合在VMAT2中的相同位点,由于RSP分子量较大,与VMAT2亲和力较强,因此可以竞争性抑制底物的结合和转运(图1A)。作者进一步通过比较两种不同构象状态的结构变化,提出了VMAT2利用alternating access方式转运底物的工作模型(图1B)。期间,作者利用大量的功能实验验证了VMAT2中的关键氨基酸残基在抑制剂结合和底物转运中的作用,极好地印证了结构方面的分析和发现,并阐明了TBZ特异性抑制VMAT2而非VMAT1的分子机制。总之,这项研究加深了人们对VMAT2及SLC18家族相关囊泡神经递质转运蛋白结构和功能机制的理解,并为针对这些蛋白质的药物研发和改造提供了重要的参考。
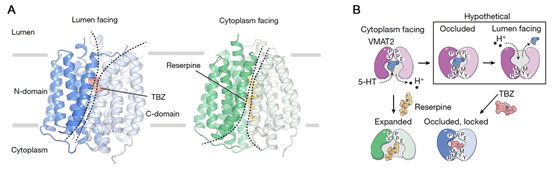
图1. VMAT2的药物抑制及底物转运机制。
美国圣裘德儿童研究医院李佳学研究员和北京大学张哲研究员为本文共同通讯作者。美国圣裘德儿童研究医院博士后Shabareesh Pidathala、北京大学前沿交叉学科研究院生命联合中心2020级博士生廖述筠和美国圣裘德儿童研究医院博士后戴亚鑫为本文共同第一作者。美国圣裘德儿童研究医院李肖和张齐伦,以及张哲课题组前技术员龙昌坤对本文做出重要贡献。另外,美国圣裘德儿童研究医院细胞和组织成像中心的工作人员、北京大学生命科学学院郑鹏里研究员及博士生简舒怡也为本研究提供了帮助。本研究得到国家重点研发计划重点专项、国家自然科学基金面上项目、生命科学联合中心、膜生物学国家重点实验室、北京大学生命科学学院启东产业创新基金、李革-赵宁生命科学青年研究基金、National Institutes of Health和ALSAC的资助;并依托北京大学生命科学学院公共仪器中心凤凰工程蛋白质平台的技术支持。
原文链接:https://www.nature.com/articles/s41586-023-06727-9