检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
BRCA1和BRCA2等重要同源重组(HR)相关基因的突变会导致乳腺癌、卵巢癌、前列腺癌等癌症,这些HR缺陷的癌症细胞通常会对PARP抑制剂(PARPi)表现出很高的敏感性,所以PARPi是治疗此类肿瘤非常有效的药物。但不幸的是,很多复发的癌症患者会表现出对PARPi的耐药性,这其中的一个主要原因之一是因为53BP1或其下游因子也在肿瘤细胞中发生了突变。BRCA1和53BP1拮抗调控了DNA双链断裂(DSBs)修复的两条途径——同源重组和非同源末端连接(NHEJ)。其中DNA末端是否发生剪切过程是DSB修复途径选择的关键因素。在HR中,BRCA1蛋白能促进DSB断裂末端DNA发生剪切,形成3’末端单链悬垂的结构;而在NHEJ通路中起作用的53BP1及其下游RIF1蛋白能抑制这一过程。具体有哪些蛋白在53BP1和RIF1下游起到抑制DNA 末端剪切从而抑制HR,以及这一过程发生的具体机制,目前还并不清楚。
2022年2月17日,北京大学生命科学学院徐冬一课题组在Nature Communication上发表文章RIF1-ASF1-mediated high-order chromatin structure safeguards genome integrity,发现RIF1蛋白一个下游因子ASF1,和RIF1形成复合体,促进NHEJ途径,抑制由BRCA1介导的HR中DNA末端剪切。同时RIF1-ASF1还能促进DSB附近染色质的异染色质化,通过改变染色质的高级结构保护DNA末端不被剪切,从而促进NHEJ修复途径。
ASF1是一种从酵母到人类细胞都很保守的组蛋白分子伴侣。高等真核生物中含有ASF1a和ASF1b两个旁系同源蛋白。已有研究表明ASF1的功能是将H3-H4提供给组蛋白分子伴侣CAF-1或HIRA,进行核小体的组装。CAF-1和HIRA能通过一个B结构域和ASF1发生相互作用。该研究发现,RIF1上也存在一个类似的B结构域,通过此和ASF1相互作用。 当细胞发生DNA损伤时,ASF1能被53BP1和RIF1招募到损伤的染色质上。ASF1缺失的细胞和RIF1缺失的细胞类似,对DNA损伤诱导药物依托泊苷(Etoposide)和ICRF193都表现出敏感性。通过遗传相互作用分析表明,ASF1作用于RIF1的下游,共同促进NHEJ修复。之前发现,在BRCA1突变的细胞中缺失RIF1,能减弱细胞对于PARPi的敏感性。同样地,ASF1的缺失也能减弱BRCA1突变细胞对于PARPi的敏感性,并恢复细胞内RAD51和RPA32在损伤处的聚集。这说明ASF1和RIF1一起,抑制BRCA1依赖的DNA末端剪切。进一步的机制研究发现,RIF1-ASF1将H3K9me1提供给了DNA断裂位点附近的染色质,而甲基转移酶SUV39h1/h2将之转化为H3K9me3,从而招募异染色质蛋白HP1,促进异染色质化的发生和染色质的压缩。该染色质高级结构的变化,限制了HR中的内切酶如CtIP-MRN等与染色质的接触,从而抑制DNA 末端剪切(图1)。
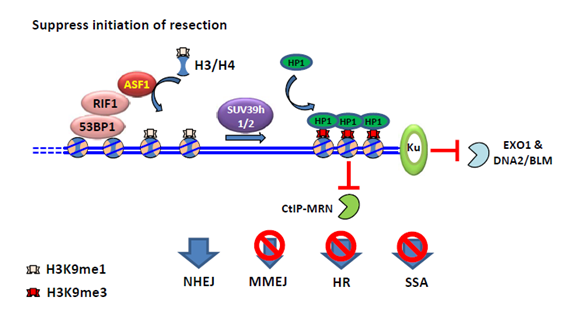
图1:RIF1-ASF1复合体对BRCA1依赖的DSB末端切除抑制的模型。
该研究发现了在NHEJ通路中RIF1下游的重要因子,揭示了NHEJ因子拮抗BRCA1介导的DNA末端剪切的分子机制。同时解释了一些BRCA1突变的肿瘤细胞对PARPi药物出现耐药性的可能原因,为相关癌症治疗提供新的靶标。
北京大学生命科学学院2019届博士冯素敏、2021届博士马赛和2018级博士研究生李可骄为该论文的并列第一作者,北京大学生命科学学院徐冬一研究员为该论文的通讯作者。此外本研究还得到了北京大学生命科学学院李晴课题组和以色列耶路撒冷希伯来大学Itamar课题组的帮助。