检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
2020年12月8日,北京大学生命科学学院徐成冉课题组和合作者在Cell Reports在线发表了题为“Large-scale Generationof Functional and Transplantable Hepatocytes and Cholangiocytes from Human Endoderm Stem Cells”的研究论文。该论文报道了规模化产生功能化且可移植的肝实质细胞和胆管细胞的新方法。
肝脏是人体内重要的代谢调控器官,对于稳态维持具有不可替代的作用。肝脏病变会诱发严重的疾病。体外产生肝系细胞对于药物肝毒性检测、肝脏疾病药物筛选及移植治疗具有重要的意义。然而,受限于技术方法等原因,迄今为止体外诱导得到的肝实质细胞和胆管上皮细胞的功能和可移植性并不成熟,并且产生的目的细胞数目有限。
我们构建了以人类内胚层干细胞(hEnSCs)为材料、高效无血清的悬浮三维肝向分化体系(图A)。相对于人的胚胎干细胞,内胚层干细胞具有易维持、无成瘤性、增殖能力强且均一化程度高的特点,并且能够有效地缩短终末分化细胞的诱导时间(Cheng et al., 2012);且悬浮三维培养体系能够在实现规模化的同时促进细胞功能成熟。通过这个分化体系诱导得到的肝实质细胞和胆管上皮细胞的效率和纯度更高,且单位前体细胞产生的终末分化细胞的数目更多。
进一步,我们通过单细胞转录组分析显示由内胚层干细胞诱导产生肝系细胞的过程接近于体内分化发育路径(Wang et al., 2020; Yang et al., 2017)(图B),但诱导得到的肝实质细胞和胆管上皮细胞具有异质性,其中一个亚群细胞的基因表达谱更接近原代肝细胞的性质。我们通过分析不同亚群细胞之间的差异表达基因,并借助发育学研究提供的线索,发现抑制EGF信号通路或激活PKC-ERK/MAPK信号通路能够分别提高肝实质细胞和胆管上皮细胞的分化效率,得到纯度更高的终末分化细胞。并且,将这种诱导得到的肝实质细胞移植入急性肝损伤的大鼠体内,能够有效地提高大鼠存活率(图C)。
因此,我们构建了全新且高效的肝向体外分化体系,通过这个体系诱导得到的肝实质和胆管上皮细胞将为肝脏体外发育研究、肝脏类器官和肝脏疾病模型体外构建、高通量药物筛选、肝脏疾病移植治疗等提供理想的细胞来源。
中国科学院上海生物化学与细胞生物学研究所、中国科学院分子细胞科学卓越创新中心程新研究员,北京大学生命科学学院、北大-清华生命科学联合中心徐成冉研究员,上海科技大学生命科学与技术学院陈洛南研究员,和上海长征医院殷浩研究员为本文的通讯作者。中国科学院上海生物化学与细胞生物学研究所冯思思博士、吴佳颖博士、邓小刚博士和北京大学生命科学学院邱伟林博士和杨李博士为共同第一作者。该课题得到了国家重点研发计划和国家重点基础研究发展计划的资助。
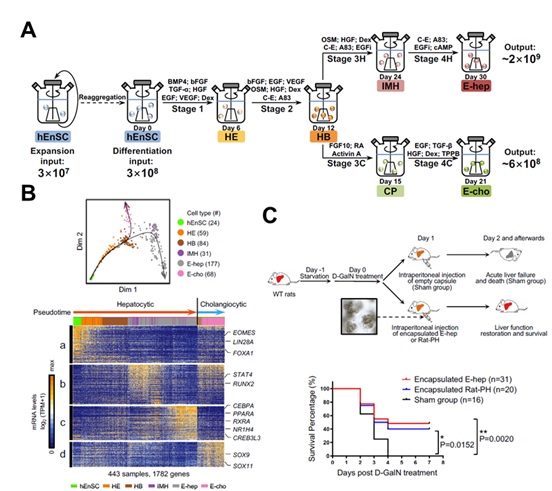
图 (A)体外规模化产生功能化且可移植肝系细胞的流程图。(B)体外肝系细胞分化路径的单细胞转录组分析。(C)诱导得到的肝实质细胞的移植显著提高急性肝损伤大鼠的存活率。
原文链接:https://www.cell.com/cell-reports/fulltext/S2211-1247(20)31444-3