检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
病理性轴突退行(Pathological axonal degeneration)是神经系统疾病中常见的一种病理变化,表现为轴突肿胀、碎裂和萎缩等。轴突退行能够进一步导致神经细胞胞体的死亡和退化,从而与各种神经退行性疾病的发生密切相关,比如,阿尔兹海默症、帕金森症等中枢神经系统疾病,以及化疗和糖尿病引起的外周神经损伤等。
轴突退行是一种特殊的程序性细胞死亡过程,不同于经典的细胞凋亡(Apoptosis)、焦亡(Proptosis)和坏死(Necroptosis)等。目前的研究显示,NAD+ (Nicotinamide adenine dinucleotide)对于维持轴突的存活至关重要。相应地,两种与NAD+代谢相关的蛋白酶对该过程起到了关键的调控作用。其中,NMNAT(Nicotinamide nucleotide adenylyltransferase)蛋白通过合成NAD+起到保护轴突的作用;相反,Sarm1(Sterile alpha and Toll/interleukin-1 receptor motif-containing protein 1)蛋白则通过降解NAD+促进轴突的退行。Sarm1蛋白在轴突退行中的核心地位使得它成为了针对神经退行性疾病药物研发的重要靶点。如果能够有效地抑制其活性,将有望抑制各种神经退行性病变的发生和发展。但是,目前为止,人们对于Sarm1蛋白如何在健康的神经细胞中活性被抑制,而只有在神经损伤和病理条件下才会被激活的分子机制还没有充分的了解,这极大地限制了药物研发的进程。
2020年10月14日,北京大学生命科学学院张哲和杨竞课题组合作在Nature杂志上发表了题为“The NAD+-mediated self-inhibition mechanism of pro-neurodegenerative Sarm1”的文章,揭示了NAD+介导的Sarm1蛋白的活性调节机制。该文章首先使用冷冻电子显微镜(cryo-EM)解析了Sarm1全长蛋白分辨率为2.6 Å的结构。结构显示,Sarm1蛋白自身以环状的八聚体形式存在,ARM结构域(Sarm1ARM)通过与TIR结构域(Sarm1TIR)的相互作用抑制了Sarm1TIR水解NAD+的活性。利用这种方式,Sarm1蛋白维持了自身在健康神经元中的活性抑制状态。更重要的是,作者通过对全长Sarm1蛋白降解NAD+活性的动力学分析发现,高浓度的NAD+对Sarm1的活性具有抑制作用,由此显示该蛋白中除了Sarm1TIR的NAD+底物结合位点外,还应该存在一个NAD+的别构调节位点,NAD+通过这种方式对Sarm1蛋白的水解酶活性发挥负调节作用。于是,作者进一步解析了Sarm1蛋白与NAD+复合物的冷冻电镜结构,在Sarm1ARM中成功发现了这个全新的NAD+结合位点。接下来,通过生物化学和神经生物学等实验,作者对这个重要的NAD+别构调节位点进行了验证,同时揭示了其对于Sarm1蛋白NAD+水解活性以及轴突退行的关键抑制作用。
由此,作者提出了Sarm1蛋白活性调节的分子机制(图1):在健康的神经细胞中,高浓度的NAD+(约500 µM)结合并稳定了Sarm1ARM的结构,使其能够与Sarm1TIR相互作用,进而抑制Sarm1TIR的NAD+水解活性;物理性损伤或病理性刺激能够一定程度上降低轴突内的NAD+水平,使得Sarm1ARM中结合的NAD+解离,这样便削弱了该结构域结构的稳定性及其与Sarm1TIR的结合能力,从而释放了Sarm1TIR的NAD+水解活性,由此引发NAD+的迅速降解。这种NAD+的急剧损失影响了细胞的能量代谢等多种生物学过程,最终导致了轴突的死亡和进一步的神经退行。
这项工作不但阐明了NAD+对于Sarm1蛋白功能调控的分子机制,而且更为针对Sarm1蛋白开展的药物研发提供了一个全新和精准的靶点。能够模拟NAD+结合并稳定Sarm1ARM结构的小分子化合物将有望被用于神经损伤及神经退行性疾病的治疗。
北京大学生命科学学院张哲研究员和杨竞研究员为该文章的共同通讯作者,张哲实验室的科研助理蒋玥凤为该论文的第一作者,杨竞实验室的刘婷婷博士、美国St. Jude Children's Research Hospital的Chia-Hsueh Lee研究员和清华大学结构生物学高精尖创新中心的常卿博士也为该工作做出了重要的贡献。该课题得到北京大学生命科学学院、生命科学联合中心、膜生物学国家重点实验室和国家自然科学基金委员会的项目资助;并依托北京大学冷冻电镜平台、高性能计算中心和生命科学学院公共仪器中心凤凰工程蛋白质平台的技术支持。
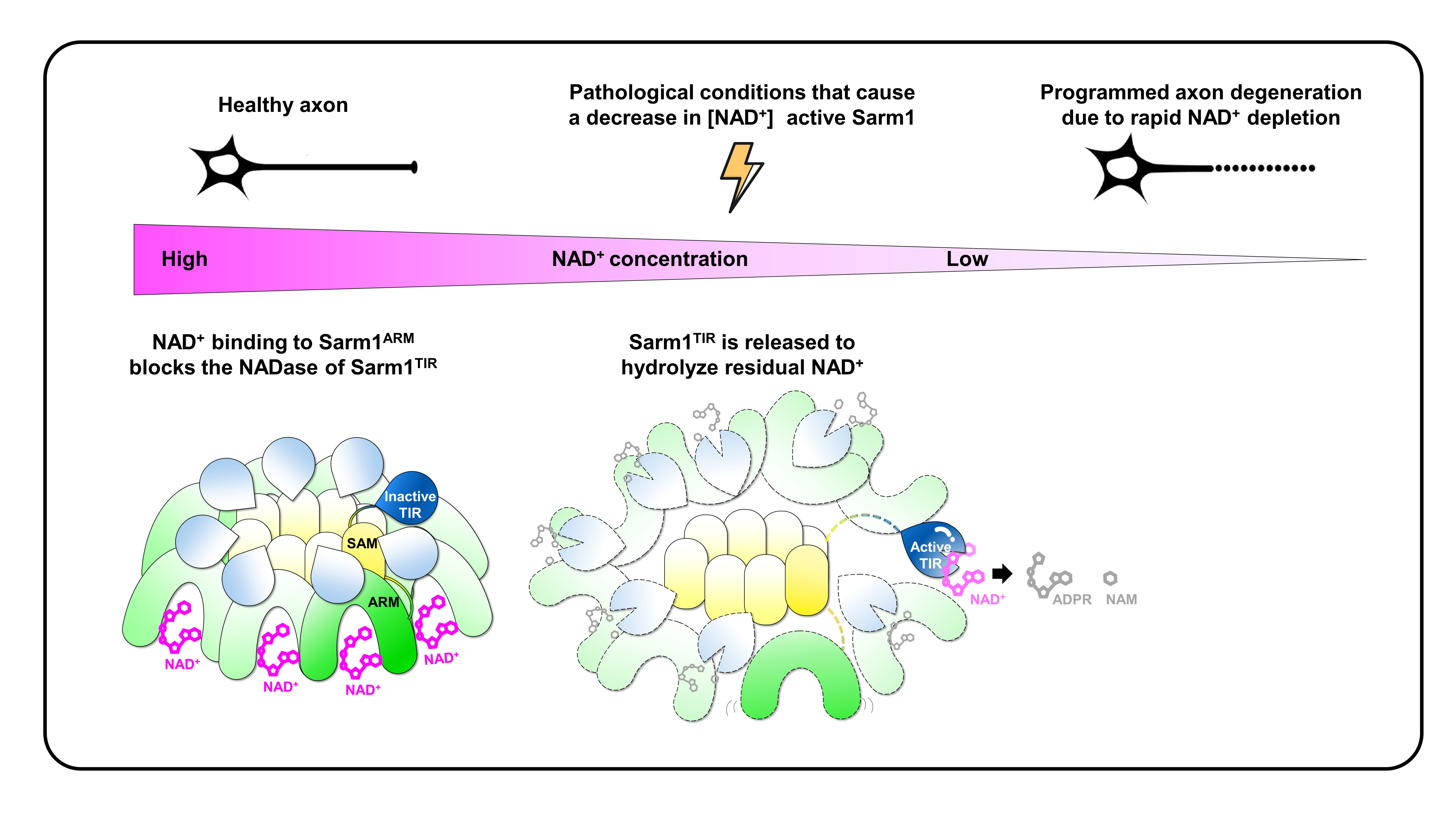
图1. NAD+介导的Sarm1蛋白的活性调节机制
原文链接: https://www.nature.com/articles/s41586-020-2862-z