检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
2020年6月22日,北京大学生命科学学院高宁教授实验室在PNAS杂志在线发表了题为“Loss of a single methylation in 23S rRNA delays 50S assembly at multiple late stages and impairs translation initiation and elongation”的研究论文。该研究工作发现,细菌核糖体大亚基中23S rRNA的U2552位点甲基化修饰的缺失,既会减缓细胞内核糖体50S大亚基的组装速度,也会降低核糖体翻译蛋白质的效率,揭示了RNA甲基化修饰对核糖体生物合成与翻译功能调控的重要意义。
核糖体(Ribosome)是由RNA和数十种蛋白质组装形成的分子机器,原核生物的核糖体分为50S大亚基和30S小亚基,它们的组装过程都高度复杂,为众多组装因子所精密调控。RNA修饰酶是其中一大类重要的组装因子,它们负责修饰核糖体RNA中保守的功能性区域,对核糖体亚基的组装和翻译功能的发挥有着重要的影响。大肠杆菌50S亚基中的23S rRNA上存在25种RNA修饰,包括13种甲基化修饰,但其准确的分子功能目前尚不明晰。甲基转移酶RrmJ从细菌到人类中都高度保守,它催化23S rRNA U2552位点的2'-O-甲基化。RrmJ的缺失会导致细菌严重的生长缺陷,以及细胞内大亚基组装中间体的累积。
在本项工作中,该团队从rrmJ敲除菌株中通过条件优化纯化出內源的核糖体组装中间体,利用冷冻电镜技术解析这些50S亚基不成熟的中间体在不同镁离子浓度下的三维空间结构。结构分析显示,这些中间体都处于晚期组装阶段,与成熟50S大亚基相比,只有L16,L35,L36这三个核糖体蛋白缺失,结构差异则集中在核糖体大亚基的功能中心——肽基转移酶活性中心(PTC,peptidyl transferase center),涉及23S rRNA的H38, H68-71和H89-93。这些结果表明U2552甲基化的缺失显著的降低了50S大亚基体内组装的效率,细胞中积累的不成熟前体的活性中心都尚未构象成熟(Fig. 1)。
此外,rrmJ敲除菌株中已经完成组装的50S大亚基的结构分析发现:U2552位点甲基化的缺失导致了临近区域G2553碱基的翻转,并使A-loop(50S亚基中负责结合tRNA的重要元件)中其它核糖核苷酸的位置发生了不同程度的偏移,暗示了这些“成熟”的50S亚基可能也有功能上的缺陷。

Fig 1. rrmJ敲除菌株不成熟50S大亚基中间体的冷冻电镜结构
基于这一线索,进一步的快速动力学的体外翻译实验表明,rrmJ敲除细菌成熟的50S亚基在翻译起始复合物的形成中只有50%的活性,与30S结合的速度也只有野生型50S的一半。突变菌的70S核糖体仍然可以行使肽键的形成、肽链的释放和核糖体循环等功能;但在每一轮肽链延伸过程中,其tRNA转位速度却都比野生型慢20% (Fig. 2)。这种层级性累积的减速将使蛋白质整体性的合成速度大大减缓。
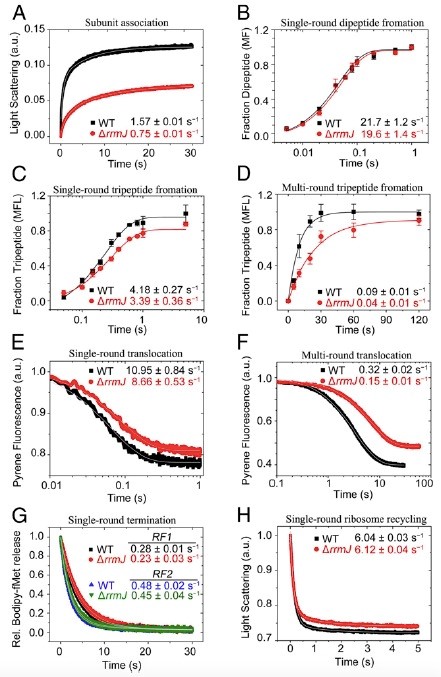
Fig 2. rrmJ敲除细菌核糖体的动力学快速生化分析
综上所述,核糖体大亚基23S rRNA上U2552位点的甲基化修饰对核糖体的生物生成的效率和蛋白质翻译速度都有重要的影响,这一发现有助于深化理解RNA修饰在核糖体调控中的功能及其分子机制。
北京大学生命科学学院高宁教授和瑞典Uppsala大学的Suparna Sanyal教授是本文的共同通讯作者,高宁实验室已毕业硕士汪伟(现为北大哲学系博士生)、已毕业博士李婉秋(现为南方科技大学博士后)和Suparna Sanyal实验室的葛学亮博士为本文共同第一作者。该项目受到国家自然科学基金委员会和科技部的项目资助。
原文链接:https://www.pnas.org/content/early/2020/06/17/1914323117