检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox

由抑制性组蛋白修饰H3K9me3所标记的异染色质在细胞分化过程中变得高度凝聚,其区域显著扩展 [1,2],形成防止已分化细胞命运逆转的重要壁垒。与此相对应,H3K9me3+异染色质区域的解压缩可以极大提高细胞重编程的效率 [3,4]。过去的研究表明,H3K9me3+异染色质的形成取决于H3K9me3的“阅读器”异染色质蛋白1(HP1)和H3K9me3的“写入器”H3K9甲基转移酶SUV39H1的协同作用 [5,6]. 然而,在生理条件下细胞分化过程中H3K9me3+异染色质凝缩、扩展的分子调控机理还尚不明晰。在终末分化的细胞中,异染色质如何调控特定基因的永久沉默更是未解之谜。
2019年12月19日,Developmental Cell杂志在线发表了北京大学生命科学学院宋艳研究组题为 Mitotic implantation of the transcription factor Prospero via phase separation drives terminal neuronal differentiation 的研究论文。该文揭示了果蝇发育过程中,一个转录因子通过液-液相分离“植入”神经前体细胞有丝分裂期染色体,通过促进H3K9me3+异染色质凝聚确保神经元终末分化的新现象和新机制。
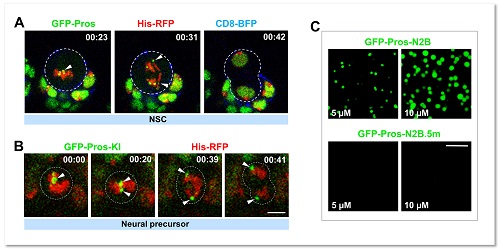
图1. 转录因子Pros通过液-液相分离植入神经前体细胞染色体
当细胞进入有丝分裂期,由于染色质凝缩形成高度致密的染色体,绝大多数基因转录的关键调控元件(包括转录因子)会从染色体上脱离。在这项工作中,研究者通过免疫荧光染色和荧光显微动态成像意外地发现转录因子Prospero(Pros)可以形成小的聚集体 (foci) 并滞留在果蝇神经前体细胞有丝分裂期染色体(图1)。Pros是在进化上高度保守的同源域 (homeobox) 转录因子,与其在哺乳动物中的同源基因Prox1一同在促进细胞终末分化过程中起着关键性的作用。那么,Pros为什么可以保留在结构致密的染色体上?这一转录因子的染色体植入 (mitotic implantation) 现象又有什么样的生理学功能?通过精细的果蝇完整脑荧光动态成像、完整脑光漂白恢复、光液滴(optoDroplet)、体外相分离等多种技术手段,研究者观察到了令人惊讶的结果,即Pros蛋白是通过液-液相分离植入并保留在神经前体细胞H3K9me3标记的近着丝粒异染色质区(图1)。当神经前体细胞进入有丝分裂末期,保留在异染色质区的Pros蛋白招募并浓缩H3K9me3阅读器 HP1a 成为相分离的凝聚体 (condensates),并促进其转变为低流动性的近凝胶状态,从而驱使新生成的神经元中H3K9me3+异染色质区域的凝缩和扩展(图2)。
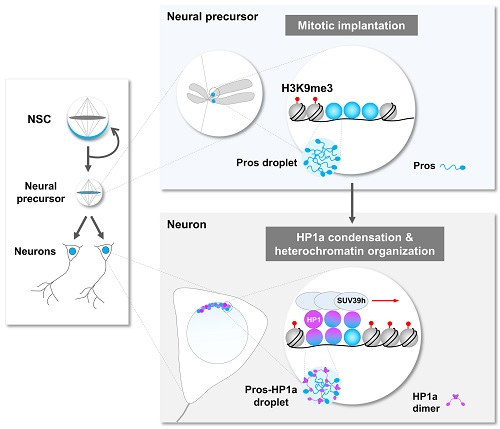
图2. 转录因子Pros通过液-液相分离驱使神经元终末分化
研究者进一步的DamID-seq、DNA FISH和动态成像实验结果表明,当神经前体细胞分裂产生两个神经元时,Pros从H3K9me3标记的异染色质区域解离下来,同时携带一部分HP1a到其关键目的基因(促进干细胞自我复制和推动细胞周期的重要基因),继而通过HP1a介导这些基因所在染色质区域发生局部凝缩,关闭这些基因的表达。另外,这些发生染色质局部凝缩的Pros目的基因位点可能通过HP1a介导的液滴融合与神经元中富含HP1a的异染色质区靠近,从而进一步促使这些关键基因的永久沉默,确保神经元的终末分化。
值得一提的是,Prox1可能也采用“染色体植入驱使异染色质凝缩”这一策略来确保神经元的终末分化。另外,研究者发现Pros蛋白还可以形成聚集体保留在果蝇肠道前体细胞的分裂期染色体上。因此,这项研究所揭示的新现象和新机理可能代表了转录因子通过染色体植入驱使异染色质凝缩和细胞终末分化的普适规律。
液-液相分离作为细胞内的一种自组织方式,为我们理解许多生物学现象提供了崭新的视角。然而,在生理条件下相分离是否真正参与调控重要的生物学过程还有待更确凿有力的证据 [7,8]。通过将Pros蛋白中介导相分离的关键位点进行点突变或删截,该工作的研究者在不影响内源表达量、入核能力及转录活性的基础上构建了特异缺失相分离能力的Pros突变体。相分离能力的特异缺失使得Pros无法保留在染色体上,相应也失去了其调节异染色质凝缩及促进神经元终末分化的功能。更为重要的是,通过与已知驱动相分离的内在无序区域(IDR)融合来恢复Pros的相分离能力, Pros的染色体滞留及其促进异染色质凝缩和神经元分化的能力可以被有效恢复。因此,通过特异的突变与回补实验和严谨的定量分析,这项研究首次建立了转录因子的液-液相变与生理条件下一系列重要生物学事件之间的因果关系,为相分离在动物发育过程中的重要生理学意义提控了强有力的证据。研究者推测其它滞留染色体的转录因子可能采用类似的液-液相分离的策略来实现其染色体滞留,并通过重塑染色质三维结构来调控细胞命运决定过程。
综上所述,这项研究出乎意料的结果揭示了转录因子通过其生物物理特性的变化引起异染色质结构重塑,进而驱动细胞终末分化的新机制,为进一步探索细胞分化过程中异染色质的动态变化和调控机理提供了新视角和新思路。
北京大学生命科学学院博士生刘晓丹(PTN 13级)和申静雯(16级)是该研究成果的共同第一作者。生命科学学院宋艳研究员是该论文的通讯作者。清华大学生命科学学院李丕龙研究员及其博士生谢雷鸣、北大生科院博士生黄祖贤(PTN 16级)和本科生魏泽林(16级)、李怡瑶(17级)、郑心和(17级)也在该课题研究中做出了重要贡献。该研究项目得到了国家自然科学基金、北大-清华生命科学联合中心和细胞增殖与分化教育部重点实验室的资助。
参考文献
1. Wen, B., Wu, H., Shinkai, Y., Irizarry, R.A., and Feinberg, A.P. (2009). Large histone H3 lysine 9 dimethylated chromatin blocks distinguish differentiated from embryonic stem cells. Nat Genet 41, 246-250.
2. Becker, J.S., Nicetto, D., and Zaret, K.S. (2016). H3K9me3-Dependent Heterochromatin: Barrier to Cell Fate Changes. Trends Genet 32, 29-41.
3. Matoba, S., Liu, Y., Lu, F., Iwabuchi, K.A., Shen, L., Inoue, A., and Zhang, Y. (2014). Embryonic development following somatic cell nuclear transfer impeded by persisting histone methylation. Cell 159:884-895.
4. Liu, Z., Cai, Y., Wang, Y., Nie, Y., Zhang, C., Xu, Y., Zhang, X., Lu, Y., Wang, Z., Poo, M., and Sun, Q. (2018). Cloning of Macaque Monkeys by Somatic Cell Nuclear Transfer. Cell 172:881-887.
5. Al-Sady, B., Madhani, H.D., and Narlikar, G.J. (2013). Division of labor between the chromodomains of HP1 and Suv39 methylase enables coordination of heterochromatin spread. Mol Cell 51, 80-91.
6. Allshire, R.C., and Madhani, H.D. (2018). Ten principles of heterochromatin formation and function. Nat Rev Mol Cell Biol 19, 229-244.
7. Alberti, S., Gladfelter, A., and Mittag, T. (2019). Considerations and Challenges in Studying Liquid-Liquid Phase Separation and Biomolecular Condensates. Cell 176, 419-434.
8. McSwiggen, D.T., Mir, M., Darzacq, X., and Tjian, R. (2019). Evaluating phase separation in live cells: diagnosis, caveats, and functional consequences. Genes Dev 33, 1619-1634.